Квантовата номера - studopediya
Всяка стойност на L съответства орбитален определена форма. Шрьодингер уравнение показва, че S-орбитален (л = 0) има сферична форма, р-орбитален (л = 1) - (. Фигура 2.1) форма гира и др ...
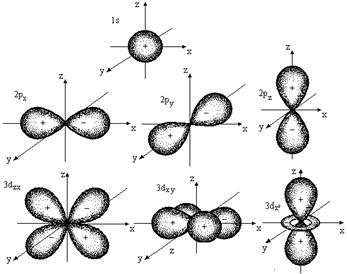
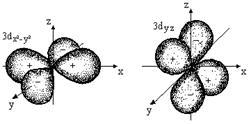
Фиг. 2.1. Форми на атомна орбитала
За електрони, на първо ниво на енергия (п = 1) е възможно само една форма на орбитали (и), за втория (п = 2) - два (а и Р) и т.н. По този начин, нивата на енергия се състои от един или повече енергийни поднива .. , За п = 1 има само един подслой с L = 0, за п = 2 - две и л = 0 и L = 1 и така нататък.
Състояние на електрон в атома се обозначи цифри и букви. Например, електрон която п = 1 и L = 0, представляват 1s. 4P състояние означава, че енергията на електрони е на четвърто ниво (п = 4); орбитали гира форма съответства (л = 1), и т.н.
Магнитното квантовата номера (т) - характеризира пространствената ориентация на орбитала. Това зависи от броя квантовата орбиталната и приема стойности от -L до нула и от нула до + л. Например, ако орбиталната квантовата номер е 0 (а-орбиталния), след това магнитното квантовата броя има една стойност (0) ако квантовата номер орбитален е 1 (р орбитала), след това магнитното квантовата броя има три стойности: -1, 0, и 1, и ако орбитален квантовата брой е 2 (г-орбиталния), след това магнитното квантовата броя има пет стойности: -2, -1, 0, 1 и 2, и т.н. Така, за всяка стойност на L има (2 L + 1) стойности на m.
Всички орбитали един подниво л имат същата енергия, но различно ориентирани един спрямо друг (фигура 2.1).
Такова електрон квантови състояния се наричат дегенеративен р-състояние тройно дегенеративен, г-състояние - петкратно т.н. (Таблица 2.3.).
Поднива и атомна орбитала
Изследване на атомните спектри показват, че три квантово число недостатъчни, за да описват свойствата на електрони.
Допълнителна четвърти брой извара-спин квантовата (и) ( "спин" - въртене, шпиндел) - характеризира присъщата механична ъглов момент на електрон движение, което обикновено представлява въртенето около оста си. Това може да стане по два противоположни посоки. Ето защо, квантовата номера на въртене има само две стойности: + 1/2 и - 1/2. Наличието на спина на електрона е експериментално потвърдени. Електроните с различни завъртания са обозначени с стрелки, сочещи нагоре и надолу.