Разтворимостта на вещества във водата
Наречен термодинамично стабилен разтвор на хомогенна (еднофазна) променлив тип система, състояща се от два или повече компонента (химикали). Компонентите, съставляващи разтворът се разтворителя и разтвореното вещество. Обикновено, компонент се счита за разтворител, който съществува в неговата чиста форма по същия агрегат състояние, и че полученият разтвор (например, в случая на воден разтворител е разтвор на сол, разбира се, вода). Ако и двата компонента са да се разтвори по подобен агрегатно състояние (например, алкохол и вода), след което разтворителят се счита компонентите, разположени в по-голямо количество.
Разтворите са течни, твърди и газообразни.
Течни разтвори - е солеви разтвори, алкохол, захар във вода. Течните разтвори могат да бъдат водни и неводни. Водни разтвори - са разтвори, в които разтворителят е вода. Неводни разтвори - са разтвори, в които разтворители са органични течности (бензен, алкохол, етер, и т.н.). Твърдите разтвори - метални сплави. Газообразни решения - въздух и други газови смеси.
Метод на разтваряне. Разтварянето - комплекс физико-химичен процес. Ако физически процес е разрушаване на структурата на разтвореното вещество и разпределението на частиците между молекули на разтворителя. Процесът на химически - взаимодействие с молекули на разтворителя на разтворените частици. В резултат на това взаимодействие се образува солвати. Ако разтворителят е вода, образуваният солват е наречен хидрати. Процесът на образуване на солвати се нарича разтваряне, образуване на хидрати - хидратация. След изпаряване на водния разтвор образува кристални хидрати - са кристални вещества, които включват определен брой водни молекули (кристална вода). Примери на кристален: CuSO4. 5H2 О - меден сулфат (II); FeSO4. 7H2 О - хептахидрат железен сулфат (II).
Физическата процеса на разтваряне отива с поглъщане на енергията, химичният - с освобождаването. Ако в резултат на хидратация (разтваряне) произвежда повече енергия, отколкото се абсорбира в разрушаването на структурата на материята, разтварянето - екзотермичен процес. Освобождаването на енергия се осъществява чрез разтваряне на NaOH, H 2SO 4. Na2 CO3. ZnSO4 и други вещества. Ако унищожаването на структурата на материята се нуждае от повече енергия, отколкото се освобождава по време на хидратация, разпадането - ендотермичен процес. Абсорбция на енергия се случва, когато се разтваря във вода NaNO3. KCI, NH4 NO3. K2 SO4. На NH4CI и някои други вещества.
Количеството енергия, която се освобождава или абсорбира при разтваряне, се нарича разтварянето на топлинна ефект.
Разтвори, наречени способността си да бъдат разпределени в друго вещество под формата на атоми, йони и молекули за формиране на термодинамично стабилна състава на променливата система. Количественият характеристика е коефициентът на разтворимост на разтворимост. което показва какво максимална маса на веществото може да бъде разтворен в 1000 или 100 грама вода при дадена температура. Разтворимостта на вещество зависи от естеството на разтворителя и същността на температура и налягане (за газове). Разтворимост на твърдите частици обикновено се увеличава с повишаване на температурата. Разтворимостта на газове намалява с повишаване на температурата, но се увеличава с увеличаване на налягането.
За водоразтворими вещества са разделени в три групи:
2. умерено (т.). Разтворимост агенти от 0,01 грама до 10 грама на 1000 г вода. Например, 2 г гипс (CaSO4. 2 Н 2О), разтворен в 1000 г вода.
3. Практически неразтворим (п.). Разтворимостта на вещества е по-малко от 0,01 гр в 1000 грама вода. Например, през 1000 г вода се разтварят 1,5. 10 -3грама AgCl.
Когато разтворени вещества могат да образуват наситени, ненаситени и свръхнаситени разтвори.
Наситен разтвор - разтвор, който съдържа максималния размер на разтвореното вещество при дадените условия. Чрез добавяне на такова вещество в разтвора е вече не разтворима субстанция.
Ненаситена разтвор - разтвор, съдържащ разтвореното вещество е по-малко от наситен при дадените условия. Чрез добавяне на такова вещество в разтвор на веществото е разтворен.
Понякога е възможно да се получи разтвор, в който разтворено вещество се съдържа повече от наситен разтвор при дадена температура. Такова решение се нарича свръхнаситен. Този разтвор се получава чрез бавно охлаждане на наситен разтвор до стайна температура. Свръхнаситени решения са много нестабилни. Кристализация вещества в разтвор може да предизвика триене със стъклена пръчка от стените на кръвоносните съдове, в които активният разтвор. Този метод се използва при извършване на някои качествени реакции.
Разтворимостта на веществото може да се експресира, и моларна концентрация на наситен разтвор (2.2).
разтворимост постоянна. Считаме процеси, протичащи във взаимодействието на умерено, но силни електролити BaSO 4 бариев сулфат с вода. Под действието на водни диполи и йони Ba 2+ SO4 2 - BaSO 4 от кристалната решетка ще се премести в течната фаза. Едновременно с този процес, под влиянието на електростатичния областта на кристална решетка част Ba 2+ йони и SO4 2 - ще бъде отново депозиран (фиг.3). При тази температура в хетерогенна система, най-накрая, равновесието е установено: скоростта на разтваряне на процеса (V1) е равна на скоростта на процеса на отлагане (V2), т.е.
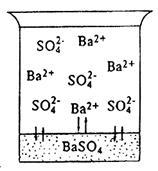
Фиг. 3. наситен разтвор на бариев сулфат
Разтворът, който е в равновесие с BaSO 4 твърдата фаза. Го наричат наситен по отношение на бариев сулфат.
Наситеният разтвор е равновесна хетерогенна система, която се характеризира с константа на химичното равновесие:
където (Ba 2+) - бариеви активност йони; а (SO4 2-) - активност на сулфатни йони;
а (BaSO 4) - активност молекули бариев сулфат.
В знаменател от тази фракция - активност кристален BaSO 4 - е константа, равна на единица. Продуктът от две константи дава нов постоянна стойност, която се нарича термодинамична и разтворимост постоянни Ks означават °:
Тази стойност се използва, за да се нарече продукта разтворимост и е права.
Така, умерено разтворими в наситен разтвор на силна равновесие електролит продукт активност на йони е постоянна при дадена температура.
Ако приемем, че умерено разтворим електролит наситен разтвор активност коефициент е
1, активността на йони в този случай може да бъде заменен от техните концентрации, както и (X) = F (X). C (X). Термодинамичната разтворимост константа К ° влиза концентрацията на разтворимост постоянни Ks:
където C (Ba 2+) и С (2 SO4 -) - равновесна концентрация на Ba 2+ йони и SO4 2 - (мол / л) в наситен разтвор на бариев сулфат.
За да се опрости изчисленията са обикновено концентрацията на разтворимост постоянни Ks. Като е (X) = 1 (Приложение 2).
Ако силна електролит образува умерено разтворим при дисоциация на някои йони в експресията Ks (Ks или °) са подходящи степен равна на стехиометричните съотношения:
Като цяло, експресията на постоянна концентрация на разтворимост електролит Am Вп # 8644; m А п + + пв m - има формата
където С - концентрация на йони А п + и В м - в наситен разтвор на електролит в мол / л.
Стойност Ks взето да се използва само по отношение на електролити, чиято разтворимост във вода не превишава 0,01 мола / литър.
Условия за образуване на утаяване
Да приемем, с - действителната концентрация йон трудно разтворими в разтвор на електролита.
Ако C m (А п +). С N (B m -)> Ks. тя ще се утаи, тъй като Разтворът става преситено.
Ако C m (А п +). С N (B m -)
Свойствата на разтворите. По-долу ние считаме, свойствата на решения на чуждестранни електролити. В случай на електролити в горната формула, се прилага изотоничен корекционен коефициент.
Ако разтваря в течна нелетлив вещество, парното налягане над разтвора е по-малко от налягането на парата над чист разтворител. Едновременно с понижаването на налягането на парите през разтвора се наблюдава промяна в неговата точка на кипене и замразяване; разтвори кипи покачване на температурата, и минусови температури спад в сравнение с температури характеризиращи чистите разтворители.
В сравнение понижаване на температурата на замръзване или относителното увеличение на температурата на кипене на разтвора е пропорционална на концентрацията:
където К - константа (cryoscopic или ebulioskopicheskaya);
Cm - molal концентриране на разтвора в мол / 1000 грама на разтворител.
Тъй Cm = m / M, където m - маса на веществото (г) в 1000 г разтворител
М - моларен маса, горната формула може да бъде написано:
; ,
По този начин, знаейки стойността за всеки разтворител чрез определяне m и експериментално определяне # 8710; т в устройството са М разтворено вещество.
Моларен маса на разтвореното вещество може да бъде определена чрез измерване на осмотичното налягане на разтвора (π) и се изчислява от уравнението Van't - Hoff:
; ,